Ve spolupráci s týmem Broad Institute – jednoho z nejvýznamnějších světových center genetického výzkumu vedeného Ericem Landerem – přispěl tým Ing. Stanislava Kmocha z Ústavu dědičných metabolických poruch 1. lékařské fakulty UK k objasnění genetické a molekulární příčiny onemocnění, které vede v dospělosti k postupné ztrátě funkce ledvin. Nové poznatky mají nejenom významné klinické dopady, ale zároveň poukazují i na slabá místa moderních technik analýzy lidského genomu. Práce byla přijata k publikaci v prestižním genetickém časopise Nature Genetics.
Vaše práce odhaluje slabiny moderních metod analýzy genomu. Jakým směrem se budou po vašem objevu ubírat projekty, ve kterých použití těchto moderních technik nebylo úspěšné?
Když dnes hledáme příčinu dědičně podmíněného onemocnění, snažíme se nejprve získat účelnou míru znalostí o genetické informaci (sekvenci DNA) postižených jedinců a jejich příbuzných. Následně porovnáváním jejich genetické informace s tzv. referenční sekvencí lidského genomu hledáme sekvenční odchylky (varianty). Nalezené sekvenční varianty dále analyzujeme ve smyslu jejich výskytu v různých populacích, předpokládané funkční závažnosti a biologické konzervovanosti. Mezi takto analyzovanými variantami, kterých může být v jednom projektu i několik tisíc, vyhledáváme takové, které splňují podmínky očekávaného modelu dědičnosti onemocnění a mají jistou funkční spojitost se studovaným fenotypem. Takto definované kandidátní varianty dále funkčně charakterizujeme a snažíme se prokázat jejich skutečnou kauzální úlohu.
Od tohoto obecného přístupu všichni očekávají, že vyřeší relativně rychle významnou většinu dědičně podmíněných onemocnění. Praxe však ukazuje, že se nám ve více než polovině projektů, které řešíme, nedaří kandidátní ani kauzální mutace nalézt.
Publikovaná práce naznačuje, že jednou z příčin neúspěchu mohou být právě mutace lokalizované v opakovaně se vyskytujících sekvencích – repetetivních oblastech DNA. Současné metody sekvenace nám neumožňují tyto rozsáhlé a sekvenčně nesmírně rozmanité oblasti lidského genomu správně analyzovat. Práce poskytuje instrukce, jak postupovat při vyhledávání a analýze těchto oblastí v doposud neúspěšných projektech. Zajímavé je v tomto směru využití tradičních technik molekulární biologie – např. kombinace hybridizační analýzy DNA (tzv. Southern blotu), klonování a Sangerova sekvenování –, od kterých se postupně v genomických laboratořích ustupuje.
Proč se moderní metody analýzy genomu nehodí pro analýzu repetetivních sekvencí?
Repetetivní sekvence jsou velmi dynamické oblasti genomu. Mají různý rozsah – od dvou nukleotidů po desítky tisíc nukleotidů. Během replikace DNA se různě kopírují, prodlužují, přesouvají se z místa na místo, převracejí. Během těchto procesů dochází ke změnám – mutacím –, které mohou mít v řadě případů funkční význam.
Aktuální metody sekvenování genomu jsou založeny na paralelní sekvenaci stovek milionů krátkých fragmentů DNA (50–200 nukleotidů) a na následném počítačovém porovnávání a přikládání jednotlivých sekvencí k referenční sekvenci. V případě repetetivních sekvencí příslušný počítačový program neví, k jaké oblasti genomu jednotlivou sekvenci přiložit, a ve většině případů ani běžně používaná referenční sekvence tyto oblasti neobsahuje. Výsledkem je, že jsou tyto sekvence z následné analýzy vyloučeny. Proto se musíme v těchto případech vrátit ke starším metodám nebo čekat na novou technologii, která nám umožní sekvenovat mnohem delší fragmenty DNA než doposud.
O nalezení genetické příčiny medulárního cystického onemocnění ledvin typu I (MCKD1) se pokoušelo více týmů již řadu let. Jak dlouho jste pracovali na projektu?
Této problematice se věnujeme od roku 1997, kdy jsme začali studovat rodiny s dědičně se vyskytující dnou a postižením ledvin. Po prvních úspěších – zejména po publikaci lokalizaci jednoho z genů na chromozomu 16 v roce 2000 – jsme začali dostávat řadu vzorků s tímto onemocněním z různých míst na světě, a to i s tímto onemocněním. Výzkum byl mimo jiné částečně podpořen v roce 2008 grantem Grantové agentury UK č. 81708. Z dnešního pohledu a z hlediska hodnocení vědy obecně je zajímavé, že ač jsme použili všechny v té době dostupné a navržené metody, a řešení nevedlo k úspěchu, byl grant hodnocen jako nesplněný, a obdrželi jsme písemnou výtku.
Dlouhé roky se vědělo, že gen a jeho mutace musejí být lokalizovány v oblasti 2 milionů bází na chromozomu 1. Na jeho nalezení pracovala řada týmů dlouhé roky, ale žádný z nich nebyl schopen kauzální mutaci nalézt. To se podařilo až Eriku Landerovi, Marku Dalymu a jejich skutečně mimořádně schopnému týmu a výjimečnému technologickém zázemí, které je na Broad Institute k dispozici. Zcela zásadní úlohu v projektu sehrál také Anthony Bleyer, náš dlouholetý kolega a výzkumný partner z Nefrologické kliniky Wake Forest University. Ten shromáždil unikátní soubor pacientů, který byl kritickým východiskem pro úspěšné vyřešení problému.
Jak přispěla právě vaše skupina k tomuto výsledku?
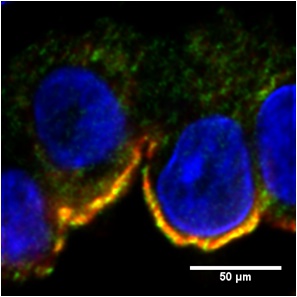
Tak jako ostatní skupiny jsme dlouhodobě neúspěšně analyzovali vzorky DNA, které jsme měli k dispozici, s použitím všech dostupných genetických technik. Paralelně s tímto přístupem jsme se však snažili určit mutovaný protein pomocí imunohistochemické detekce. V bioptických vzorcích ledvin jsme analyzovali proteiny, které jsou přítomné v tubulárních buňkách ledvin.
Na základě těchto experimentů jsme dlouho tušili, že oním proteinem musí být mucin-1. Měli jsme několik pozorování u pacientů z našeho souboru, která ukazovala na změnu exprese tohoto proteinu. Kauzální mutaci ani žádný jasný histopatologický závěr jsme však nebyli schopni nikdy nalézt. Dnes již víme proč. V důsledku mutace totiž vzniká úplně nový typ proteinu, který jsme našimi postupy nemohli dříve detekovat. Po nalezení kauzální mutace a odhalení základního dopadu mutace na strukturu mucimu-1 jsme však byli schopni rychle navrhnout a připravit protilátku, jež mutovaný protein v řadě biopsií specificky prokázala.
Naše analýza tak potvrdila výsledky genetické analýzy kolegů z Broad Institute a naznačila základní patogenetické mechanismy postupného snižování funkce tubulárních buněk ledvin. Jako v řadě dalších podobných projektů se nám opět potvrdilo, že molekulárně patologický přístup ke studiu genetických onemocnění, směr, který dlouhá léta rozvíjel profesor Milan Elleder, je jednou z velkých přidaných hodnot našeho pracoviště. Právě díky tomuto přístupu, který koreluje genetické, biochemické a molekulární poznatky s patologií buňky a orgánu, se nám daří odhalovat nové poznatky o příčinách onemocnění a fyziologických a patofyziologických mechanismech u člověka.
Jakým způsobem pomůže objev při léčbě pacientů?
MCKD1 se nedá klinicky určit. Diagnóza je možná pouze na základě genetického vyšetření nebo naší imunohistochemické analýzy. Dokud nebylo možné tato vyšetření provést, nikdo nevěděl, kdo tímto specifickým onemocněním trpí a jak se vlastně toto onemocnění projevuje. To je dnes možné a my víme o desítkách postižených rodin a stovkách pacientů na všech kontinentech.
|
„Program UNCE je jedno z nejsmysluplnějších opatření na podporu vědy na Univerzitě Karlově,“ říká Ing. Stanislav Kmoch z Ústavu dědičných metabolických poruch 1. lékařské fakulty UK |
Medulární cystické onemocnění ledvin (MCKD1) patří podobně jako polycystóza do skupiny dědičně podmíněných onemocnění, která se projevují v dospělosti postupnou ztrátou funkce ledvin a ve většině případů vyžadují následnou dialýzu a transplantaci. Onemocnění se vyskytuje v rodinách opakovaně v několika generacích a u přímých příbuzných (strýců, tet, bratranců či sestřenic). U každého potomka postiženého jedince je 50% riziko, že onemocnění zdědí. |